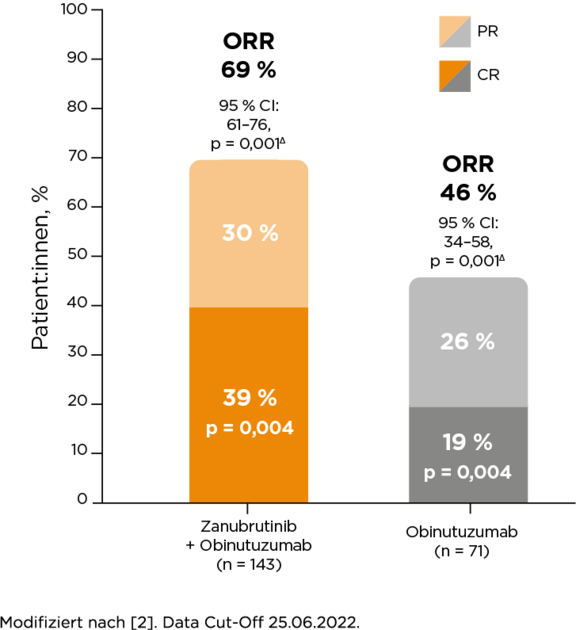ASPEN-Zulassungsstudie
Brukinsa® bei Morbus Waldenström
Indikation
Brukinsa® (Zanubrutinib) ist zugelassen zur Behandlung erwachsener Patient:innen mit Morbus Waldenström (MW), die mindestens eine vorherige Therapie erhalten haben oder zur Erstlinientherapie bei Patient:innen, die für eine Chemo-Immuntherapie nicht geeignet sind.1
Studiendesign
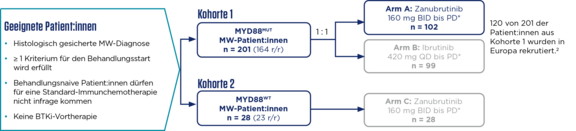
- Größte open-label, randomisierte Phase-3-Studie in der Indikation Morbus Waldenström (N = 229)2
- Head-to-Head-Vergleich von Brukinsa® mit Ibrutinib (n = 201)2
Primärer Endpunkt: Anteil der Patient:innen mit CR oder VGPR (nach IRC) |
Wichtigste sekundäre Endpunkte: MRR, DoR, PFS, Tumorlast, Sicherheit
Stratifizierungsfaktoren (Kohorte 1): u. a. CXCR4-Status
Modifiziert nach [1,2].
Wirksamkeit in Kohorte 1
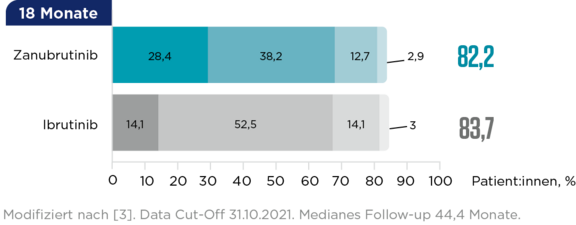
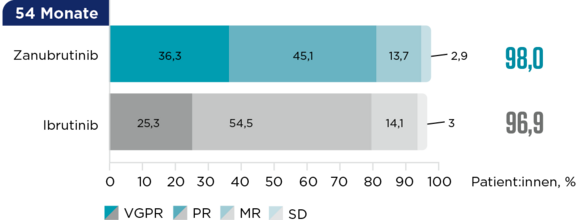
Ansprechraten über die Zeit bei MYD88MUT-Patient:innen3
Progressionsfreies Überleben (ITT-Population)3
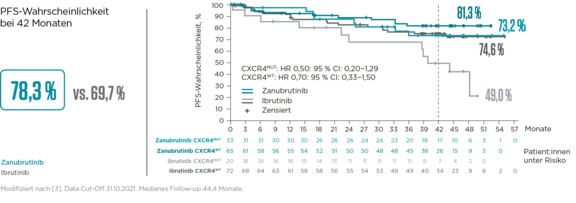
Progressionsfreies Überleben nach CXCR4-Status (Kohorte 1)3
-
Langanhaltende Krankheitskontrolle mit Brukinsa® vs. Ibrutinib bei MW – unabhängig von Vorbehandlung oder Mutationsstatus (MYD88, CXCR4)3
-
Schnelles Ansprechen unter Brukinsa® und langanhaltende IgM Reduktion2,3
Sicherheit in Kohorte 1
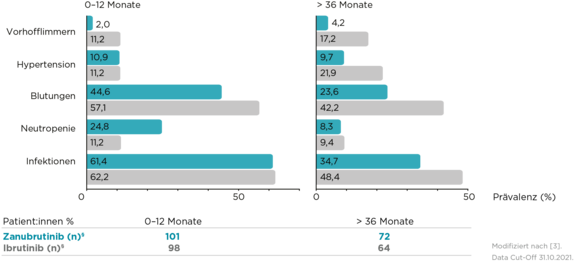
Prävalenz ausgewählter UE im zeitlichen Verlauf3
Vorteilhaftes Sicherheitsprofil, auch im kardiovaskulären Bereich, von Brukinsa® vs. Ibrutinib bei MW im Langzeit-FU3

bis zur VGPR (vs. 16,6 Monate unter Ibrutinib; Kohorte 1)3
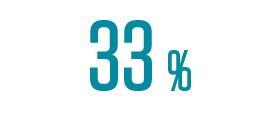
der Patient:innen älter als 75 Jahre (Kohorte 1)3
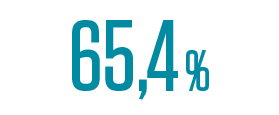
starkes Ansprechen (MRR) bei MYD88WT-Patient:innen (Kohorte 2)3

IgM-Reduktion2,3
- Inhalt
ROSEWOOD-Zulassungsstudie
Brukinsa® beim follikulären Lymphom
Indikation
Brukinsa® (Zanubrutinib) wird in Kombination mit Obinutuzumab angewendet zur Behandlung von erwachsenen Patient:innen mit refraktärem oder rezidiviertem follikulärem Lymphom (FL), die mindestens zwei vorherige systemische Therapien erhalten haben.1
Studiendesign
Die Zulassungsstudie ROSEWOOD (BGB-3111-212) ist eine multizentrische, randomisierte, offene Phase-2-Studie. Die Kombination aus Zanubrutinib + Obinutuzumab wurde Head-to-Head mit einer Obinutuzumab-Monotherapie bei r/r FL-Patient:innen verglichen.2
Das mediane Follow-up betrug 20,2 Monate.2
Primärer Endpunkt:2 ORR*
Wichtigste sekundäre Endpunkte:2 ORR** | DoR | PFS*** | OS | CR | CMR-Rate | TTR | PRO | Sicherheit | Pharmakokinetik
Ein Cross-over von Patient:innen aus dem Obinutuzumab-Arm in den Zanubrutinib + Obinutuzumab-Arm war bei Krankheitsprogress oder stabiler Erkrankung nach 12 Monaten möglich.2
Wirksamkeit
Sicherheit
- Inhalt
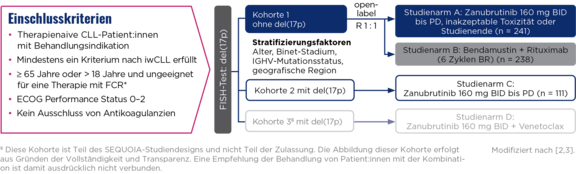
SEQUOIA-Zulassungsstudie
Brukinsa® bei chronischer lymphatischer Leukämie
Indikation
Brukinsa® (Zanubrutinib) ist als Monotherapie zur Behandlung erwachsener Patient:innen mit chronischer lymphatischer Leukämie (CLL) zugelassen.1
Studiendesign
Die Zulassungsstudie SEQUOIA (BGB-3111-304) ist eine multizentrische, randomisierte, offene Phase-3-Studie, in der Zanubrutinib mit Bendamustin + Rituximab (BR) bei therapienaiven CLL-Patient:innen verglichen wurde.2,3
Primärer Endpunkt (Kohorte 1): PFS**
Sekundäre Endpunkte (Kohorte 1): ORR, OS, DoR, Sicherheit
5-Jahres-Follow-up der SEQUOIA-Studie:
Medianes Follow-up: 61,2 Monate (0–78,0 Monate)
Wirksamkeit
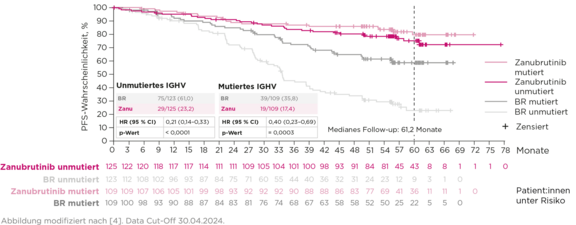
PFS nach IGHV-Status in Kohorte 1 (Arm A + B)
Signifikanter PFS-Vorteil –
unabhängig vom IGHV-Status4
Ähnliches PFS bei Brukinsa®-Patient:innen mit und ohne IGHV-Mutation4,§§
60-Monats-PFS-Rate§§§: 75,8 % Brukinsa® vs. 40,1 % BR4
Einziger BTKi# mit PFS-Vorteil bei IGHVmut-Patient:innen vs. CIT6–9
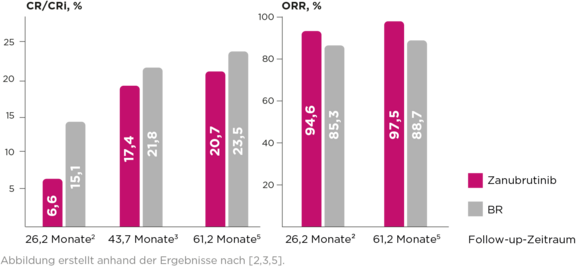
- Hohe, im Studienverlauf ansteigende CR/CRi-Raten unter Brukinsa®5
- Hohe Ansprechraten unter Brukinsa® (ORR 97,5 % nach 61,2 Monaten)5
- Inhalt
MAGNOLIA-Zulassungsstudie
Brukinsa® beim rezidivierten/refraktären Marginalzonenlymphom
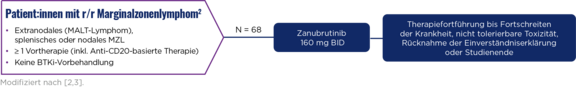
Indikation
Eine Brukinsa®-Monotherapie (Zanubrutinib) wird zur Behandlung erwachsener Patient:innen mit Marginalzonenlymphom (MZL) angewendet, die mindestens eine vorherige Therapie mit einem Anti-CD20-Antikörper erhalten haben.1
Studiendesign
Die MAGNOLIA-Studie ist eine open-label, einarmige Phase-2-Studie, die die Wirksamkeit und Sicherheit von Zanubrutinib bei Patient:innen mit rezidiviertem/refraktärem (r/r) Marginalzonenlymphom untersucht hat, die mindestens eine vorherige Therapie mit einem Anti-CD20-Antikörper erhalten haben.2,3
Primärer Endpunkt: ORR (IRC)*
Sekundäre Endpunkte: ORR (INV-assessed), PFS, OS, DoR, Sicherheit
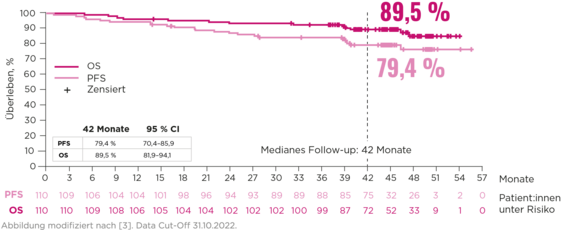
Wirksamkeit
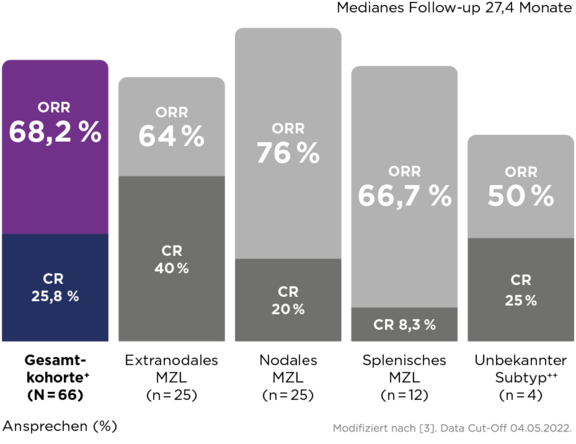
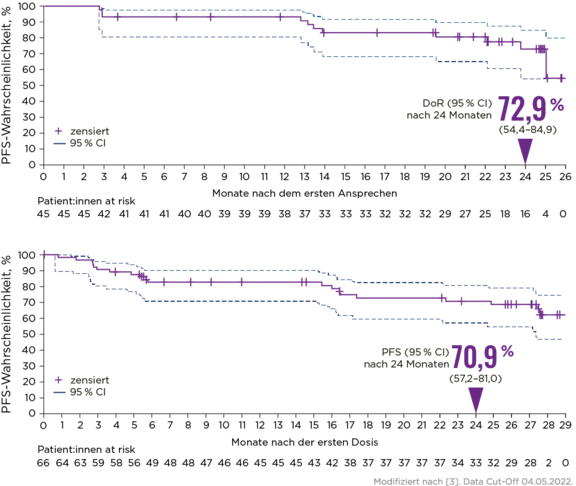
Langanhaltende Krankheitskontrolle (nach einem medianen Follow-up von 27,4 Monaten) mit Zanubrutinib bei r/r Marginalzonenlymphom – unabhängig vom untersuchten Subtyp und auch bei Hochrisiko-Patient:innen:2,3
- Hohes Gesamtansprechen: 68,2 % ORR3
- Anhaltendes Ansprechen: 72,9 % DoR (nach 24 Monaten)3
Sicherheit
- Inhalt
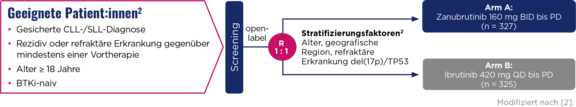
ALPINE-Zulassungsstudie
Brukinsa® bei chronischer lymphatischer Leukämie
Indikation
Brukinsa® (Zanubrutinib) ist für die Behandlung von erwachsenen Patient:innen mit chronischer lymphatischer Leukämie (CLL) zugelassen.1
Studiendesign
Die Zulassungsstudie ALPINE (BGB-3111-305) ist eine globale, randomisierte, offene Head-to-Head-Phase-3-Studie zur Behandlung von Patient:innen mit r/r CLL und SLL.2
Primärer Endpunkt: ORR (PR + CR)*,**
Sekundäre Endpunkte: PFS** | Rate von Vorhofflimmern/-flattern | OS | PR-L oder besser | DoRZeit bis zum Therapieversagen | Sicherheit
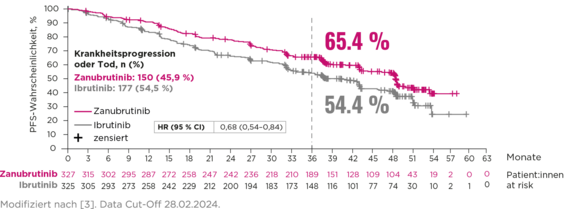
Wirksamkeit
Progressionsfreies Überleben (PFS, Investigator-assessed) in der ITT-Population3,†
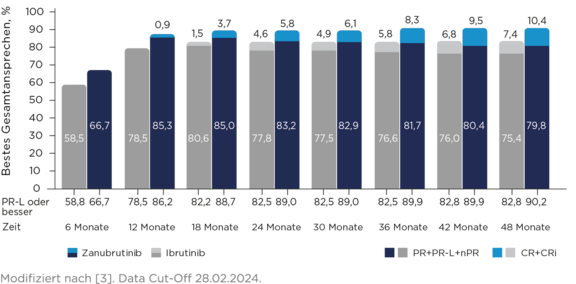
Gesamtansprechraten über die Zeit3
Sicherheit
- Inhalt
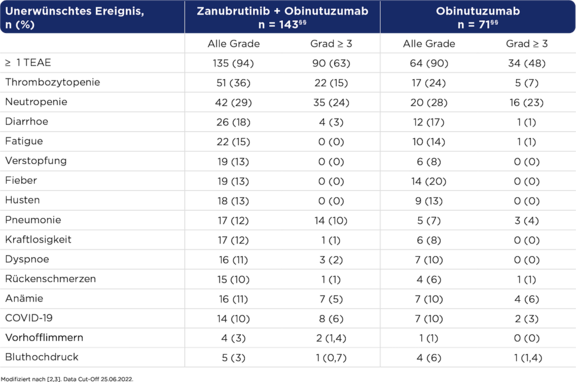
Verträgliches Sicherheitsprofil¥ von Zanubrutinib + Obinutuzumab in der Therapie stark vorbehandelter Patient:innen mit r/r FL.2,3
Neue Sicherheitssignale wurden nicht beobachtet.2
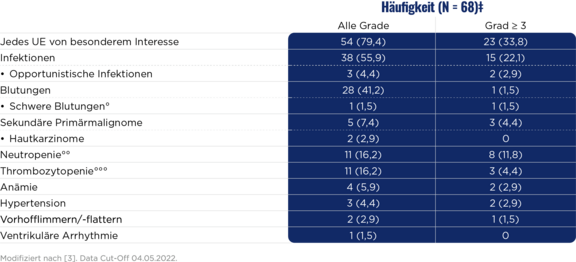
Anhaltend gute Verträglichkeit von Zanubrutinib bei Patient:innen mit r/r Marginalzonenlymphom:2,3
Zahlenmäßig geringe kardiale UE3,ŧ
Keine neuen Sicherheitssignale beobachtet3
Brukinsa®: Anhaltend gute Verträglichkeit nach 61,2 Monaten Follow-up4,5
Fast 70 % der Patient:innen erhalten nach wie vor Brukinsa®4
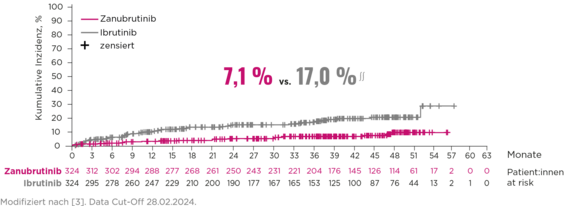
7,1 % niedrigere oder vergleichbare VHF-Rate (7,1 %) vs. andere BTKi##
27 % konsistentes Sicherheitsprofil ohne neue Sicherheitssignale, auch bei älteren Patient:innen (82 % ≥ 65 Jahre, davon 27 % ≥ 75 Jahre)4
Vorteilhaftes Sicherheitsprofil von Zanubrutinib – auch im kardialen Bereich.3,∫∫∫
Signifikant geringere Raten an Vorhofflimmern/-flattern und keine neuen Sicherheitssignale nach 42,5 Monaten Nachbeobachtungszeit.3
Referenzen
1. Gültige Fachinformation BRUKINSA® 160mg Filmtabletten. 2. Zinzani PL et al. ROSEWOOD: A phase II randomized study of Zanubrutinib plus Obinutuzumab versus Obinutuzumab monotherapy in patients with relapsed or refractory follicular lymphoma. J Clin Oncol 2023; 41: 5107–5117 + Suppl. ROSEWOOD ist eine randomisierte, open-label Phase-2-Studie (N = 217). Arm A (Zanubrutinib plus Obinutuzumab, n = 145) und Arm B (Obinutuzumab, n = 72). 3. Flowers CR et al. Zanubrutinib plus Obinutuzumab versus Obinutuzumab in patients with relapsed or refractory follicular lymphoma: Updated analysis of the ROSEWOOD study. Poster zu Abstract #7545, Presented at ASCO 2023, June 2-6, Chicago, Illinois, USA.
1L = 1st Line (Erstlinie) | 2L = 2nd Line (Zweitlinie) | BID = Bis In Die (zweimal täglich) | BTKi = Bruton-Tyrosinkinase-Inhibitor | CD = Cluster of Differentiation (Oberflächenmerkmal) | CI = Confidence Interval (Konfidenzintervall) | CMR = Complete Metabolic Response (komplettes metabolisches Ansprechen) | CR = Complete Response (komplette Remission) | DoR = Duration of Response (Ansprechdauer) | ECOG = Eastern Cooperative Oncology Group | FL = Follikuläres Lymphom | FLIPI = Follicular Lymphoma Interational Prognostic Index (Internationaler Prognoseindex für Follikuäres Lymphom) | HR = Hazard Ratio | IRC = Independent Review Committee (unabhängiges Review-Komitee) | i.v. = intravenös | NE = Not Evaluable (nicht auswertbar) | ORR = Overall Response Rate (Gesamtansprechrate) | OS = Overall Survival (Gesamtüberleben) | PD = Progressive Disease (Krankheitsprogress) | (m)PFS = (Median) Progression-Free Survival ((medianes) progressionsfreies Überleben) | PR = Partial Response (partielles Ansprechen) | PRO = Patient Reported Outcomes (von Patient:innen berichtete Ergebnisse) | R = Randomisiert | r/r = refraktär/rezidivierend | TEAE = Treatment-Emerged Adverse Event (behandlungsbedingtes unerwünschtes Ereignis) (m)TTNT = (Median) Time To Next Treatment ((mediane) Zeit bis zur nächsten Therapie) | TTR = Time To Response (Zeit bis zum Ansprechen)
° Bis PD.
°° Bis PD oder maximal 30 Monate.
* Durch ein IRC gemäß der Lugano-Klassifikation beurteilt.
** Investigator-assessed.
*** IRC-assessed. Δ 2-seitiger p-Wert.
+ ORR (IRC-assessed) 69 % unter Zanubrutinib + Obinutuzumab (95 % CI: 61–76, p = 0,001) vs. 46 % unter Obinutuzumab (95 % CI: 34–58, p = 0,001) mit einem Risikounterschied von 23 % (95 % CI: 9–37, p = 0,001).2
++ U. a. Alter, zwei oder mehr Vortherapien, Bulky Disease, FLIPI etc.
# IRC-Bewertung.
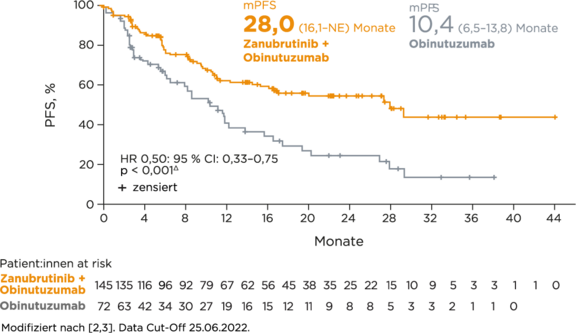
## Medianes PFS 28,0 (16,1–NE) Monate unter Zanubrutinib + Obinutuzumab vs. 10,4 (6,5–13,8) Monate unter Obinutuzumab (HR 0,50; 95 % CI: 0,33–0,75, p < 0,001).2,3
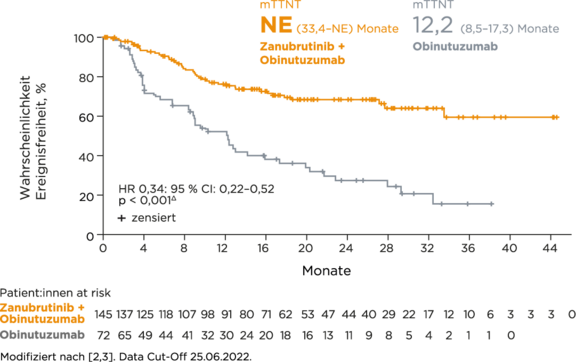
§ mTTNT NE (33,4–NE) Monate im Zanubrutinib+Obinutuzumab-Arm vs. 12,2 (8,5–17,3) Monate unter Obinutuzumab-Monotherapie (HR 0,34; 95 % CI: 0,22–0,52, p < 0,001).2,3
§§ In die Sicherheitsanalyse wurden alle Patient:innen eingeschlossen, die ≥ 1 Behandlungsdosis erhielten.
¥ Günstiges Risiko-Nutzen-Profil von Zanubrutinib + Obinutuzumab mit geringerem Auftreten von Fieber und infusionsbedingten Reaktionen vs. Obinutuzumab sowie geringe Häufigkeit für das Auftreten von Vorhofflimmern und Hypertension in beiden Studienarmen.3
Pflichttext/Fachinformation
Referenzen
1. Gültige Fachinformation BRUKINSA® 160mg Filmtabletten. 2. Tam CS et al. A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenström macroglobulinemia: the ASPEN study. Blood 2020; 136(18): 2038–2050 + Suppl. ASPEN ist eine randomisierte, open-label Phase-3-Studie mit Head-to-Head-Vergleich von Zanubrutinib vs. Ibrutinib (N = 201). Kohorte 1: Arm A (Zanubrutinib, n = 102) und Arm B (Ibrutinib, n = 99). Kohorte 2 (nicht-randomisiert): Arm C (Zanubrutinib, n = 28). 3. Dimopoulos MA et al. Zanubrutinib Versus Ibrutinib in Symptomatic Waldenström Macroglobulinemia: Final Analysis From the Randomized Phase III ASPEN Study. J Clin Oncol 2023; 41(33): 5099–5106 + Suppl.
BID = Bis In Die (zweimal täglich) | BTKi = Bruton-Tyrosinkinase-Inhibitor | CI = Confidence Interval | CR = Complete Response (komplette Remission) | CXCR4 = CXC-Motiv-Chemokinrezeptor 4 DoR = Duration of Response (Ansprechdauer) | FU = Follow-up | HR = Hazard Ratio | IgM = Immunglobulin M | IRC = Independent Review Committee | ITT = Intent To Treat MR = Minor Response (schwaches Ansprechen) | MRR = Major Response Rate (Hauptansprechrate) | MUT = Mutation | MW = Morbus Waldenström | MYD88 = Myeloid Differentiation Primary Response 88 PD = Progressive Disease (Krankheitsprogress) | PFS = Progression-Free Survival (progressionsfreies Überleben) | PR = Partial Response (partielles Ansprechen) | QD = Quaque Die (einmal täglich) | r/r = refraktär/ rezidivierend | SD = Stable Disease (stabile Erkrankung) | UE = Unerwünschte Ereignisse | VGPR = Very Good Partial Response (sehr gute partielle Remission) | WT = Wildtyp
* Bis Krankheitsprogression oder Intoleranz.2
+ Akutes Herzversagen, Tod (ungeklärt), Lungenentzündung, Sepsis (n = 2).
++ Kardiomegalie (Herzstillstand nach Plasmapherese), metastasiertes malignes Melanom, Subduralhämatom (nach Sturz).
# Herzerkrankungen (n = 4, davon 2 aufgrund von Vorhofflimmern), Infektion und parasitäre Erkrankungen (n = 4, Pneumonie und Sepsis; jeweils 2), Erkrankungen der Atemwege, des Brustraums und Mediastinums (n = 3), Zweitmalignom (n = 3), Erkrankungen des Blut- und Lymphsystems (n = 2), Erkrankungen der Nieren und Harnwege (n = 1), Tod unbekannter Ursache (n = 1), arzneimittelinduzierte Leberschädigung (n = 1), Hepatitis (n = 1).
## Sekundärmalignom (n = 4, umfasst Brustkrebs, metastasiertes Melanom, Multiples Myelom und myelodysplastisches Syndrom; jeweils 1), Kardiomegalie (n = 1), arzneimittelinduzierte Leberschädigung (n = 1), Neutropenie (n = 1), Subduralblutung (n = 1), Verschlechterung einer chronischen Nierenerkrankung (n = 1).
§ n ist die Anzahl an Patient:innen, die in diesem Zeitintervall unter Behandlung waren oder die die Behandlung unterbrachen.
Pflichttext/Fachinformation
Referenzen
1. Gültige Fachinformation BRUKINSA® 160mg Filmtabletten. 2. Opat S et al. The MAGNOLIA trial: Zanubrutinib, a next-generation Bruton tyrosine kinase inhibitor, demonstrates safety and efficacy in relapsed/refractory marginal zone lymphoma. Clin Cancer Res. 2021; 27: 6323-32. Data Cut-Off 18.01.2021. 3. Opat S et al. Safety and efficacy of zanubrutinib in relapsed/refractory marginal zone lymphoma: final analysis of the MAGNOLIA study. Blood Adv 2023; 7: 6801-6811. Data Cut-Off: 04.05.2022.
1L = 1st Line (Erstlinie) | 2L = 2nd Line (Zweitlinie) | BID = Bis In Die (zweimal täglich) | BTK(i) = Bruton-Tyrosinkinase(-Inhibitor) | CD = Cluster of Differentiation (Oberflächenmerkmal) | CI = Confidence Interval (Konfidenzintervall) | CR = Complete Response (komplette Remission) | DoR = Duration of Response (Ansprechdauer) | INV = Investigator | IRC = Independent Review Committee (unabhängiges Review-Komitee) | MALT = Mucosa Associated Lymphoid Tissue (Mukosa-assoziiertes lymphatisches Gewebe) | MZL = Marginalzonenlymphom | ORR = Overall Response Rate (Gesamtansprechrate) | OS = Overall Survival (Gesamtüberleben) | PFS = Progression-Free Survival (progressionsfreies Überleben) | r/r = refraktär/rezidivierend | UE = Unerwünschtes Ereignis/ Unterwünschte Ereignisse
* Der primäre Endpunkt der Gesamtansprechrate wurde von einem unabhängigen Untersuchungsgremium (Independent Review Committee, IRC) gemäß der Lugano-Klassifikation ermittelt. Die ORR der Gesamtkohorte betrug 68,2 % (95 % CI 55,6–79,1 %); p < 0,001).
+ 2 Patient:innen wurden von der Wirksamkeitsanalyse ausgeschlossen, da das IRC ihre Erkrankung als diffuses großzelliges B-Zell-Lymphom einstufte.
++ Diese Patient:innen zeigten sowohl nodale als auch extranodale Läsionen. Aus diesem Grund konnte der primäre Subtyp durch die Investigatoren nicht klassifiziert werden.
‡ Laut Definition wurden in die Sicherheitsanalyse alle Patient:innen eingeschlossen, die mindestens 1 Dosis der Studienmedikation erhielten.3
° Definiert als schwere Blutung oder Blutung ≥ 3. Grades an einer beliebigen Stelle oder eine Blutung des Zentralnervensystems jeglichen Grades.
°° Umfasst Neutropenie und erniedrigte Neutrophilenzahl.
°°° Umfasst Thrombozytopenie und erniedrigte Thrombozytenzahl.
ŧ Bei drei Patient:innen wurde eine Hypertonie beobachtet, je ein:e Patient:in litt an Vorhofflimmern und -flattern.3
Pflichttext/Fachinformation
Referenzen
1. Gültige Fachinformationen BRUKINSA® 160mg Filmtabletten. 2. Tam CS et al. Zanubrutinib versus Bendamustine and Rituximab in untreated chronic lymphocytic leukaemia and small lymphocytic lymphoma (SEQUOIA): a randomised, controlled, phase 3 trial. Lancet Oncol 2022; 23: 1031–1043. + Suppl. SEQUOIA ist eine randomisierte, open-label, Phase-3-Studie (N = 590). Kohorte 1: Arm A (Zanubrutinib, n = 241) und Arm B (BR, n = 238). Kohorte 2 (nicht-randomisiert): Arm C (Zanubrutinib, n = 111). Data Cut-Off 27.07.2021. 3. Munir T et al. Zanubrutinib (Zanu) vs. Bendamustine + Rituximab (BR) in patients (pts) with treatment-naïve chronic lymphocytic leukemia/small lymphocytic lymphoma (CLL/SLL): Extended follow-up of the SEQUOIA study. Poster plus Abstract #P639. Presented at EHA 2023. Data Cut-O 31.10.2022. 4. Shadman M et al. Zanubrutinib versus Bendamustine and Rituximab in patients with treatment-naïve chronic lymphocytic leukemia/small lymphocytic lymphoma: Median 5-year follow-up of SEQUOIA. J Clin Oncol 2025; DOI doi.org/10.1200/JCO-24-02265. Data Cut-Off 30.04.2024. 5. Shadman M et al. Sustained superiority of Zanubrutinib vs Bendamustine + Rituximab in treatment-naïve chronic lymphocytic leukemia/small lymphocytic lymphoma: 5-year follow-up of cohort 1 from the SEQUOIA study. Poster #3249 presented at ASH 2024, Dec 7-10. 6. Sharman JP et al. Efficacy and safety in a 4-year follow-up of the ELEVATE-TN study comparing Acalabrutinib with or without Obinutuzumab versus Obinutuzumab plus Chlorambucil in treatment-naive chronic lymphocytic leukemia. Leukemia 2022; 36: 1171–1175. 7. Sharman JP et al. Acalabrutinib +/- Obinutuzumab vs Obinutuzumab + Chlorambucil in treatment-naive chronic lymphocytic leukemia: 6-year follow-up of ELEVATE-TN. Blood 2023; 142(suppl 1): 636 (abstract and oral presentation). 8. Woyach JA et al. Follow-up from the A041202 study shows continued e cacy of Ibrutinib regimens for older adults with CLL. Blood 2024; 143: 1616–1627. 9. Sharman JP et al. Acalabrutinib +/- Obinutuzumab versus Obinutuzumab + Chlorambucil in treatment-naıve chronic lymphocytic leukemia: Five-year follow-up of ELEVATE-TN. J Clin Oncol 2022; 40: 7539.
BID = Bis In Die (zweimal täglich) | BR = Bendamustin + Rituximab | BTKi = Bruton-Tyrosinkinase-Inhibitor | CI = Confi dence Interval (Konfi denzintervall) | CIRS = Cumulative Illness Rating Scale (kumulative Krankheitsbewertungsskala) | CIT = Chemo-Immuntherapie | CLL = Chronische Lymphatische Leukämie | CR = Complete Response (komplette Remission) | CRi = Complete Response with incomplete hematologic recovery (komplette Remission mit unvollständiger hämatologischer Erhohlung) | del = Deletion | DoR = Duration of Response (Ansprechdauer) | ECOG = Eastern Cooperative Oncology Group | FCR = Fludarabin + Cyclophosphamid + Rituximab | FISH = Fluoreszenz-in-situ-Hybridisierung | HR = Hazard Ratio | IGHV = Immunoglobulin Heavy Chain Variable Region (Immunglobulin-Schwerkette: variable Region) IRC= Independent Review Committee (unabhängiges Review-Komitee) | iwCLL = International Workshop on CLL (Internationaler Workshop zur CLL) | mut = mutiert | ORR = Overall Response Rate (Gesamtansprechrate) | OS = Overall Survival (Gesamtüberleben) | PD = Progressive Disease (Krankheitsprogress) | PFS = Progression-Free Survival (progressionsfreies Überleben) | R = Randomisiert | TN = Therapie-naiv VHF = Vorho immern | Zanu = Zanubrutinib
* Definiert als ≥ 65 Jahre, CIRS-Score > 6, Kreatinin-Clearance < 70 ml/min oder schwerwiegende oder häufige Infektionen im Krankheitsverlauf.2
** Von einem IRC ermittelt.2 Gemessen vom Zeitpunkt der Randomisierung bis zu Krankheitsprogression oder Tod.2
§ Diese Kohorte ist Teil des SEQUOIA-Studiendesigns und nicht Teil der Zulassung. Die Abbildung dieser Kohorte erfolgt aus Gründen der Vollständigkeit und Transparenz. Eine Empfehlung der Behandlung von
Patient:innen mit der Kombination ist damit ausdrücklich nicht verbunden.
§§ HR 1,35 (95 % CI 0,76–2,40).4
§§§ Geschätzte 60-Monats-PFS-Raten.
# Kovalenter BTKi.
## Vergleichbare VHF-Rate vs. andere BTKi in Phase-3 Follow-up-Studien und entsprechend der einer alternden CLL-Population.4
Pflichttext/Fachinformation
Referenzen
1. Gültige Fachinformationen BRUKINSA® 160mg Filmtabletten. 2. Brown JR et al. Zanubrutinib or Ibrutinib in relapsed or refractory chronic lymphocytic leukemia. N Engl J Med 2023; 388: 319–332. + Suppl. ALPINE ist eine globale, randomisierte, open-label, Phase-3-Studie mit Head-to-Head-Vergleich von Zanubrutinib vs. Ibrutinib (N = 652). Arm A (Zanubrutinib, n = 327) und Arm B (Ibrutinib, n = 325). 3. Brown J et al. Sustained benefit of Zanubrutinib vs Ibrutinib in patients with r/r CLL/SLL: Final comparative analysis of ALPINE. Blood 2024; 2024024667 + Suppl. DOI: doi.org/10.1182/blood.2024024667.
BID = Bis In Die (zweimal täglich) | BTK(i) = Bruton-Tyrosinkinase(-Inhibitor) | CI = Confidence Interval (Konfi denzintervall) | CLL = Chronische Lymphatische Leukämie | CR = Complete Response (komplette Remission) | CRi = Complete Response with Incomplete hematologic recovery (komplette Remission mit unvollständiger hämatologischer Erholung) | del = Deletion | DoR = Duration Of Response (Ansprechdauer) FDA = Food and Drug Administration | HR = Hazard Ratio | IRC = Independent Review Committee (unabhängiges Review-Komitee) | ITT = Intention to Treat | mut = Mutation | nPR = near Partial Response (nahezu partielles Ansprechen) | ORR = Overall Response Rate (Gesamtansprechrate) | OS = Overall Survival (Gesamtüberleben) | PD = Progressive Disease (Krankheitsprogress) | PFS = Progression-Free Survival (progressionsfreies Überleben) | PR = Partial Response (partielles Ansprechen) | PR-L = Partial Response with Lymphocytosis (partielles Ansprechen mit Lymphozytose) | QD = Quaque Die (einmal täglich) R = Randomisiert | r/r = refraktär/rezidivierend | RR = Relatives Risiko | SLL = Small Lymphocytic Lymphoma (kleinzelliges lymphozytisches Lymphom) | TEAE = Treatment-Emergent Adverse Event (behandlungsassoziiertes unerwünschtes Ereignis) | TP = Tumorsupressorprotein | UE = Unerwünschtes Ereignis.
* Der primäre Endpunkt der ORR wurde von Investigatoren beurteilt und wurde defi niert als komplettes Ansprechen (CR), komplettes Ansprechen mit unvollständiger Knochenmarkerholung, partielles
noduläres Ansprechen oder partielles Ansprechen (PR).2
** Sowohl der primäre Endpunkt der ORR als auch der wichtige sekundäre Endpunkt des PFS wurde von Investigatoren bewertet. Zum Zweck der Einreichung bei der FDA wurden beide Endpunkte
zusätzlich von einem unabhängigen Review-Komitee (IRC) bestimmt.
† Medianes Follow-up 42,5 (0,1-60,5) Monate: 43,4 (0,1-59,6) Monate Zanubrutinib und 41,6 (0,1-60,5) Monate Ibrutinib.
# Die Gesamtansprechrate blieb unter Zanubrutinib höher als unter Ibrutinib (85,6 % vs.75,4 %); die Ansprechraten vertieften sich im Laufe der Zeit mit CR/CRi von 11,6 % (Zanubrutinib) und 7,7 % (Ibrutinib).3
## Insgesamt erreichten 5 Patient:innen eine CR/CRi jenseits von 48 Monaten (n = 4 unter Zanubrutinib, n = 1 unter Ibrutinib).3
∫ Kombinierter bevorzugter Begriff gemäß MedDRA (Medical Dictionary for Regulatory Activities). Patient:innen, die mehrere Ereignisse eines der bevorzugten Begri e und aus einer der Kategorien von
besonderem Interesse erlebten, wurden für jeden der bevorzugten Begriffe bzw. jede Kategorie nur einmal erfasst.
∫∫ Inzidenz nach medianer Expositionszeit von 41,2 Monaten (Zanubrutinib) und 37,8 Monaten (Ibrutinib).
∫∫∫ Die Zahl kardialer Ereignisse war unter Zanubrutinib geringer (25,9 % vs. 35,5 %) bei ähnlichen Blutdruckraten. Das Auftreten von Vorhofflimmern/-flattern war unter Zanubrutinib niedriger als unter Ibrutinib (7,1 % vs. 17,0 %). Ebenso waren mit Zanubrutinib Therapieabbrüche aufgrund kardialer Ereignisse niedriger als unter Ibrutinib (0,9 vs. 4,9 %).3